特色原料藥及關鍵醫藥中間體生產基地建設項目可行性案例
(一)項目基本情況和投資概算
本項目為特色原料藥及關鍵醫藥中間體生產基地建設項目,規劃建設期 2年,實施主體為奧翔藥業。該項目總投資 44,910.63 萬元,其中建設投資 42,796.43萬元,鋪底流動資金 2,114.21 萬元。
(二)項目建設的具體內容
本次項目的產品主要包括 5 個原料藥產品和 7 個醫藥中間體產品,5 個原料藥產品分別為拉坦前列素硝酸酯、非布司他、阿哌沙班、舒更葡糖鈉、咪達普利鹽酸鹽,7 個醫藥中間體產品分別為 SK01、SK03、AGN-H、AGN-L、LA-05、BAL-01、BAL-02。
(三)項目實施背景
1、全球醫藥行業持續鎮長,仿制藥高速發展,原料藥及中間體行業相應增長
世界人口總量的增長、社會老齡化程度的提高、人們保健意識的增強、疾病譜的改變、全球城市化進程的加快、各國醫療保障體制的不斷完善,種種因素推動了全球醫藥行業的發展,進而帶動了全球藥品市場的發展。根據 IQVIA 發布的《2019 年全球藥物使用情況和 2023 年展望:預測和關注領域》報告,2017年全球藥品支出 11,350 億美元,而 2018 年則達到了 12,050 億美元,到 2023 年,這一數字預計將超過 1.5 萬億美元。
在醫藥行業中,全球仿制藥市場的增長速度已趕上并超過全球醫藥市場的增速,且未來數年內,仿制藥市場的增速將繼續保持較高水平,成為全球醫藥支出增長尤其是新興醫藥市場增長的主要驅動因素。從全球市場來看,2014 年至 2020年七年內,有近 2,590 億美元銷售額的原研藥專利到期,專利藥品到期給全球仿制藥市場提供巨大的市場空間,為仿制藥相關企業帶來了新的發展契機。仿制藥行業的快速增長將增加相關特色原料藥和醫藥中間體的市場需求,并對原料藥企業的研發、創新能力提出更高的要求。
2、全球原料藥行業重心遷移,發展中國家快速崛起
20 世紀 90 年代以前,歐洲和美國是全球最主要的原料藥生產區,規模大,技術水平先進。20 世紀 90 年代以后,隨著環保、成本等方面的原因,歐洲和美國逐步降低原料藥產能,特別是美國,多數仿制藥公司都沒有自己的原料藥生產車間,主要依賴進口。同時,以中國和印度為代表的發展中國家快速崛起,成為主要的原料藥生產和出口國家。
在特色原料藥行業領域,美國、歐洲等發達國家憑借研究開發、生產工藝及知識產權保護等多方面的優勢,在附加值較高的專利藥原料藥領域占據主導地位;而中國、印度則依靠成本優勢在仿制藥原料藥市場中占重要地位。隨著中國、印度等發展中國家對特色原料藥行業的重視和扶持,以及特色原料藥廠商不斷加大研發投入、改進生產技術、提高工藝水平,并投資改善生產設備形成專業化生產線,發展中國家的特色原料藥研發工藝水平,尤其是仿制藥相關的特色原料藥和中間體的研發工藝水平,已呈現追趕并超越美國、歐洲等發達國家的趨勢。
3、國內宏觀政策紅利
2015 年以來,圍繞“健康中國”戰略,國家密集出臺一系列的宏觀政策,為我國醫藥企業的發展注入新的動力。2016 年 2 月,國務院在春節后的第一次常務會議上將“部署推動醫藥產業創新升級”作為主要的會議內容。在此之后,國務院出臺了《關于促進醫藥產業健康發展的指導意見》。
2016 年 10 月,中共中央、國務院發布了《“健康中國 2030”規劃綱要》,作為我國健康事業的行動綱領,首次在國家層面提出了健康領域中長期的戰略規劃,把“健康中國”戰略提升至前所未有的高度。“健康中國 2030”勢必會推動我國醫藥創新和轉型升級,是我國醫藥健康產業轉型升級的重大機遇。
2020 年 1 月,工業和信息化部、生態環境部、國家衛生健康委、國家藥監局發布《推動原料藥產業綠色發展的指導意見》,指出到 2025 年,產業結構更加合理,采用綠色工藝生產的原料藥比重進一步提高,高端特色原料藥市場份額顯著提升;產業布局更加優化,原料藥基本實現園區化生產,打造一批原料藥集中生產基地;技術水平有效提升,突破 20 項以上綠色關鍵共性技術,基本實現行業綠色生產技術替代;綠色標準不斷完善,建立原料藥綠色工廠、綠色園區、綠色管理標準評價體系,發揮優勢企業綠色發展引領作用。
在多項政策利好環境下,醫藥健康產業將在“十三五”期間引領我國經濟新一輪的發展浪潮。經濟的發展、人口的增長、社會老齡化程度加重以及民眾健康意識的不斷增強,種種因素使得我國醫藥行業保持高速增長。與此同時,醫保壓力過大,政府倡導進一步醫保控費,對提高仿制藥使用比例來控制醫保費用支出的依賴持續加強,這都為我國仿制藥行業的長期發展創造了巨大的機會。
4、行業監管力度和標準逐步提高
2015 年以來密集出臺的相關監管法規政策為我國醫藥行業的長遠發展提供了保障,促進我國醫藥行業的健康可持續發展。由于我國長期以來一直片面強調仿制藥標準性研究,而忽視了與原研藥的對比性研究,造成仿制藥質量和療效與原研藥一致性數據的缺失。目前我國大力推進的仿制藥一致性評價工作,也是世界各國提高仿制藥質量的必經歷程。
隨著仿制藥一致性評價工作的開展,借鑒國外先進經驗,適應我國產業發展和用藥需求的仿制藥評價方式、監管體系和生產標準等將不斷地調整和完善,仿制藥質量必將得到全面提高,在臨床上實現與原研藥的相互替代,改變原研藥藥品銷售價格居高不下的局面,擴大我國仿制藥市場滲透率。仿制藥,尤其是高水平仿制藥是各國降低醫保負擔的重要杠桿,我國有效開展仿制藥一致性評價工作的意義重大。短期內加強監管或會加大醫藥企業的經營風險和成本,但長期則會使我國仿制藥行業在優勝劣汰中迎來洗牌,產業結構得到有效優化,真正具有技術研發實力的公司將會脫穎而出。
(四)項目實施的必要性和可行性分析
1、項目實施的必要性
(1)解決產能緊張、優化公司產品結構、提升公司盈利能力的必然要求
公司目前雖然已有多種掌握核心技術的中間體、原料藥產品及多種工藝成熟的儲備產品,但受制于產能結構化緊張、資金短缺等不利因素,公司研發優勢和產品儲備優勢尚未充分發揮。同時隨著下游制劑客戶新藥臨床后期乃至獲批上市后商業化階段的產能需求增大,公司面臨著較大的產能壓力。
通過實施特色原料藥及關鍵醫藥中間體生產基地建設項目,一方面在下游制劑客戶研發新藥及報批階段,公司即能提供相應的中間體或原料藥,提高在其后期商業化生產階段的采購粘性,提高公司的國際競爭力;另一方面結合目前公司的產品結構調整與市場需求,發揮原料藥的產業技術優勢,增加產品種類數量,擴大新型優勢原料藥的出口,為滿足持續增長的國內外市場需求提供產能支持,為進一步拓展國際市場以便在市場開發中獲得更多主動權。
(2)進一步完善生產規范,樹立公司形象,提升公司競爭力的必然要求
相比擁有悠久歷史的全球醫藥行業巨頭,公司在 cGMP 藥品生產管理規范和 EHS 體系建設方面,還有很大的提升空間。公司雖然通過了諸多全球醫藥行業巨頭的現場審計甚至成為部分產品的合格供應商,但公司與其的合作還只是處于初期階段,若要實現與其深度的合作,必須繼續加強自身的生產規范建設。本次計劃實施的特色原料藥及關鍵醫藥中間體生產基地建設項目,完全按照美國、歐洲、日本的 cGMP 藥品生產規范和嚴格的 EHS 體系進行建筑、設備、工藝方面設計。通過實施特色原料藥及關鍵醫藥中間體生產基地建設項目,公司將進一步完善自身的質量體系和生產規范化管理,幫助公司在全球市場樹立良好的公司形象,提升公司的競爭力。
2、項目實施的可行性
(1)公司具備了實施本項目的技術基礎
公司自成立以來,一直致力于特色原料藥和關鍵醫藥中間體的研究、生產和銷售。公司經過多年的經營,培養了緊密有效的團隊合作,為新產品開發和上市提供了堅強后盾。公司掌握并成功應用了豐富的化學合成技術工藝,包括手性誘導技術、不對稱還原技術、綠色合成技術、催化技術、特定反應器技術等具有領先水平的技術;建立完整的反應體系,能夠從事如催化氫化、偶聯、水解、酯化、氨化等傳統化學工藝,以及如手性催化、手性誘導、金屬催化、生物催化等前沿性化學工藝。
本次募投項目涉及的十二個產品,都已攻克了原專利工藝路線或開發出新的自主知識產權的路線,具體情況如下:
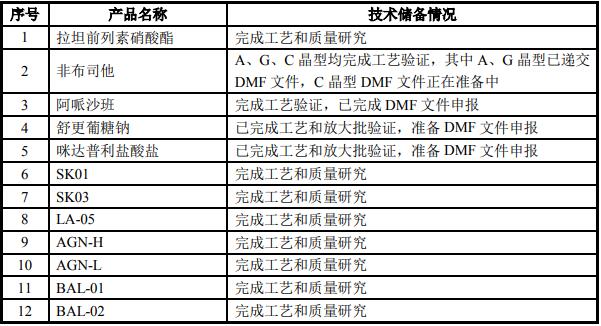
公司的現有技術成果,已經為募投產品的順利投產和市場開拓提供了堅實的技術保障。公司始終保持高度的危機感,繼續對現有技術的改進和路線的探索保持極高的熱情。
(2)公司具備承擔本次募投項目的市場基礎
本次募投項目產品均是經過公司反復的論證與判斷后,篩選出的市場前景廣闊、具有相當競爭優勢的產品。在募投項目產品研發立項前,公司就開始聯系潛在客戶,征集客戶的研發意向;研發過程中,公司繼續保持與潛在客戶的聯絡,了解其需求和標準,調整公司的研發規格。研發完成前的積極溝通,使得公司的研發進度與客戶的項目進展相匹配,研發完成后,第一時間向潛在客戶提供樣品,經其確認質量合格后,入圍合格供應商。研發立項前的反復論證以及研發過程中與客戶的積極聯絡,是募投項目產品具備良好市場前景的重要保證。
免責聲明:
1、本站部分文章為轉載,其目的在于傳遞更多信息,我們不對其準確性、完整性、及時性、有效性和適用性等作任何的陳述和保證。本文僅代表作者本人觀點,并不代表本網贊同其觀點和對其真實性負責。
2、中金普華產業研究院一貫高度重視知識產權保護并遵守中國各項知識產權法律。如涉及文章內容、版權等問題,我們將及時溝通與處理。